Principe et caractéristiques de la « Rétrodiffusion Rutherford »
Le principe de la méthode RBS est celui d’un cochonnet frappant une lourde boule de pétanque. Les cochonnets sont les ions légers provenant d’un accélérateur comme AGLAE. Les boules de pétanque sont les noyaux lourds présents dans l’échantillon à analyser. La collision est dite élastique. L’énergie cinétique et la quantité de mouvement totales sont conservées. Le cochonnet et la boule restent cochonnet et boule ; l’ion reste ion et le noyau cible noyau cible.
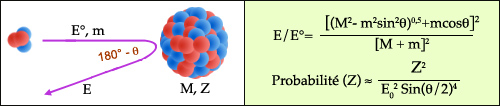
Rétrodiffusion Rutherford : deux formules
La méthode RBS utilise deux lois de la physique. La première, d’origine cinématique, fournit le rapport de l’énergie E du projectile rétrodiffusé – proton, deuton, noyau d’hélium – et de son énergie initiale E°, fonction de l’angle théta de diffusion. Ce rapport dépend du rapport des masses m du projectile et M du noyau cible. La seconde loi due à Rutherford donne la probabilité de rebondissement en fonction de l’angle. A grand angle (proche de 180°), cette probabilité varie comme le carré de la charge du noyau cible. Elle est beaucoup plus élevée pour les noyaux lourds que pour les noyaux légers.
© IN2P3/C2RMF
La méthode RBS consiste à compter le nombre d’ions projectiles (protons, deutons, noyaux d’hélium) qui rebondissent vers l’arrière lorsqu’ils sont repoussés par le champ électrique d’atomes-cible du matériau analysé. Deux formules permettent de comprendre l’intérêt de cette rétrodiffusion pour identifier la présence de noyaux d’atomes lourds dans un échantillon.
La première formule résulte de l’application des lois fondamentales de la mécanique. Lors de la collision, l’énergie cinétique et la quantité de mouvement du système projectile-cible sont les mêmes avant et après la collision. Selon ces lois de conservation, l’énergie des ions diffusés à un angle donné théta (choisi généralement dans la gamme 150-170° par rapport à la direction du faisceau) possède une valeur unique caractéristique de la masse du noyau-cible.
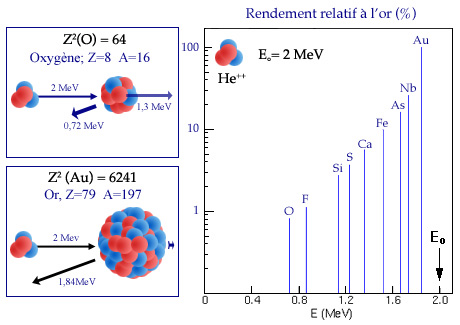
La rétrodiffusion Rutherford pour les noyaux lourds
Rebondissement vers l’arrière d’une particule alpha de 2 MeV sur un noyau d’oxygène (Z=8) et d’or (Z=79). A droite, valeurs des énergies de la cible et du projectile après le rebond. La figure de droite compare, dans le cas de cette rétrodiffusion vers l’arrière, l’énergie E du rebond et sa probabilité pour une série de cibles allant de l’oxygène à l’or (les probabilités sont comparées à l’or). On voit que le projectile alpha propulse davantage vers l’avant le noyau relativement léger d’oxygène (A=16) que le noyau lourd d’or (A=197), mais il perd plus d’énergie et rebondit moins.
© IN2P3
La seconde formule due à Rutherford fournit la probabilité (appelée section efficace) de la diffusion à un angle thêta donné. Dans le domaine des angles voisins de 180° qui nous intéressent, cette probabilité est approchée. Pour un angle fixé et une énergie initiale donnée, cette probabilité varie comme le nombre de protons Z du noyau (autrement dit sa charge électrique) au carré. Z représente le nombre atomique de l’atome.
La figure ci-dessus montre l’application des deux formules dans le cas d’un noyau projectile d’hélium de 2 MeV d’énergie et de noyaux cibles d’oxygène et d’or pris comme exemple. Les masses atomiques de l’hélium, de l’oxygène et de l’or sont de 4, 16 et 197. Les énergies de recul sont bien séparées (0,72 et 1,84 MeV), mais surtout un noyau d’or (Z=79) « rétrodiffuse » à lui seul autant que 97,5 noyaux d’oxygène (Z=8).
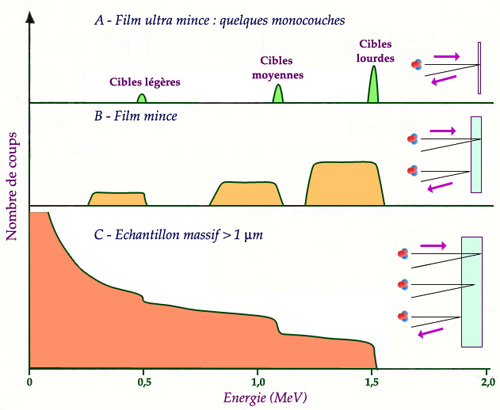
Influence de l’épaisseur de l’échantillon
On considère ici une cible comportant 3 types d’atomes cibles, légers, moyens et lourds. Dans le cas d’une cible ultra mince composé de quelques couches atomiques, le spectre se réduit aux énergies caractéristiques des éléments chimiques présents. Ces pics se transforment en plateaux quand la cible s’épaissit du fait de la perte d’énergie de l’ion incident dans le trajet aller et de celle de l’ion diffusé dans le trajet retour. Le spectre obtenu avec une cible épaisse présente une forme particulière constituée de marches successives ayant un front situé à l’énergie caractéristique de chaque élément et une hauteur en proportion de leur concentration atomique.
© C2RMF
Dans la méthode RBS, un détecteur recueille les ions rétrodiffusés, mesure leur énergie et les compte. Le résultat est un spectre des énergies à interpréter. Mais sauf dans le cas d’échantillons ultra minces, l’énergie recueillie n’est pas celle de la formule. Au moment où l’ion est repoussé par un noyau lourd, son énergie n’est plus celle fournie par l’accélérateur. Il a traversé une certaine profondeur de matière dont il a ionisé des atomes, ce qui l’a ralenti. Après le rebond, l’ion est à nouveau ralenti lors du trajet retour. La perte d’énergie aller et retour est d’autant plus grande que le projectile s’est enfoncé profondément.
Les éléments chimiques légers sont « transparents » vis à vis de la rétrodiffusion Rutherford. En effet, il n’y a pas de rebond en arrière pour un élément chimique de masse égale ou inférieure à l’ion projectile. Si la masse de l’élément chimique n’est pas très supérieure (cas de l’oxygène et de l’hélium), la probabilité de rétrodiffusion est faible, l’énergie perdue dans le rebond forte. La plupart du temps, l’ion perd le peu d’énergie qui lui reste lors de son trajet retour et n’atteint pas le détecteur.
Quels projectiles choisir, protons ou noyaux d’hélium, pour une analyse RBS ? Les protons sont plus pénétrants mais moins sélectifs. S’il s’agit de privilégier des éléments chimiques intermédiaires et lourds, les noyaux d’hélium sont généralement préférés. Comme leur masse atomique est de 4, ils ne voient pas les espèces chimiques les plus communes (carbone, oxygène, azote, etc…) contrairement aux protons de masse atomique unité.
Les autres articles sur le sujet « Atome au musée »
L’accélérateur AGLAE
Un outil moderne pour l’analyse d’œuvres d’art Pourquoi recourir à un accélérat[...]
AGLAE : Extraction faisceau
Analyser les objets à l’air au moyen de particules accélérées sous vide Les ions utilisés pour l’[...]
La méthode PIXE
Une analyse ultra-sensible de surfaces La technique d’analyse la plus employée auprès de l&[...]
Méthode RBS
La RBS ou « Spectrométrie de Rétrodiffusion Rutherford » La méthode RBS est une méthode d’a[...]