L’expérience qui prouva l’existence d’un noyau dans l’atome
En 1908, Ernest Rutherford reçoit le prix Nobel pour l’identification des particules alpha à l’hélium. Lors de son discours Nobel, il est à même de préciser que ces atomes d’hélium sont doublement ionisés. Ce résultat fait sensation, car il est le résultat d’ultimes mesures faites avant son voyage en Suède.
Rutherford ne s’en tient pas là, il poursuit ses recherches sur les propriétés des rayonnements radioactifs. Dans la liste des expériences à faire après son retour de Stockholm, il a inscrit la diffusion des particules alpha, c’est-à-dire la manière dont ces particules sont déviées en traversant la matière.
En 1903, Philip Lenard, bombardant les atomes avec des rayons cathodiques avait remarqué que ceux-ci traversaient les atomes comme s’ils ne trouvaient presque rien sur leur trajet. Il avait résumé ses observations en disant qu’à l’échelle atomique « la matière solide est transparente » et remarqué que « l’espace occupé par un mètre cube de platine solide est aussi vide que l’espace séparant les étoiles de la terre ».
Observant que des particules alpha de très grande vitesse étaient déviées par une mince feuille de mica, Rutherford calcule le champ électrique à l’intérieur du mica et en déduit qu’il doit être très puissant.
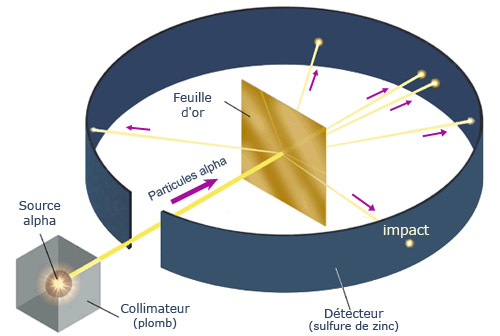
Schéma de l’expérience de Rutherford
Bombardant de très fines feuilles d’or par des particules alpha, Hans Geiger et Ernest Marsden, alors étudiants de Rutherford, observèrent qu’une fraction minime (1 sur 8000) de ces particules étaient défléchies à grand angle comme si elles rebondissaient sur un obstacle massif. Les impacts étaient observés dans l’obscurité au microscope sur un écran de sulfure de zinc scintillant. Rutherford en conclut que l’atome contenait un cœur massif, de charge électrique positive, capable de repousser les alpha.
DR
Mais il faut pouvoir détecter et compter les particules alpha qui sont diffusées. Avec son assistant Hans Geiger, Rutherford met au point une méthode permettant de le faire. Le résultat de leurs observations confirme l’existence de champs électriques intenses. Reste tout de même une énigme : quelques particules alpha sont très déviées.
Rutherford demande à un jeune assistant Ernest Marsden de voir s’il y a des particules alpha qui subissent une forte déviation en traversant une mince feuille d’or et même rebondissent en arrière. C’est le cas ! C’est dans l’obscurité et à l’œil nu, que Rutherford, Geiger et Marsden comptent les scintillations dues aux impacts des particules alpha sur un écran de sulfure de zinc.
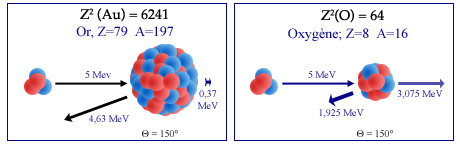
Rétrodiffusion d’un alpha sur un noyau
Rutherford observa le rebondissement vers l’arrière de particules alpha envoyées comme projectiles sur les atomes d’une mince feuille d’or. Il interpréta ce rebondissement comme la « rétrodiffusion » d’un noyau léger (la particule alpha) sur le noyau lourd d’un atome d’or. Étant donné le rapport des masses (A=4 contre A=197), la particule alpha qui rebondit sur la figure de gauche à 150° ne perd qu’une petite partie de son énergie – qu’elle communique au noyau d’or – ce qui lui permet de ressortir de la feuille d’or. Au contraire, dans le cas d’une collision à droite avec un noyau beaucoup plus léger comme l’oxygène (A=16), l’alpha perd la plus grande partie de son énergie au profit de l’oxygène propulsé vers l’avant.
© IN2P3
Rutherford remarque dans une phrase devenue célèbre que « tout se passe comme si vous bombardiez une feuille de papier avec un obus de 15 pouces, que le projectile rebondisse et vous touche ». Rétrospectivement Rutherford fit cette remarque devenue célèbre, pour décrire l’étonnement qu’il ressentit : « It was as if you fired a 15 inch shell at a piece of tissue paper and it came back and hit you ». Étant données leur énergie, leur vitesse et leur masse, les particules pouvait en être comparées à des obus frappant la mince couche d’atomes d’or traversée. Rutherford étudie le phénomène pendant une année et trouve l’explication : la charge positive des atomes se trouve dans un noyau massif et compact. Ce noyau concentre presque toute la masse de l’atome, mais n’occupe qu’une centaine de millionième de millionième de son volume. L’atome est vide, quasiment à cent pour cent.
Les autres articles sur le sujet « Les découvertes »
Marie Curie
Marie Sklodowska-Curie a eu un destin exceptionnel. Née en Pologne, elle vint faire ses études su[...]
Trois rayonnements
Trois lettres de l’alphabet grec pour trois rayonnements Dans les années qui suivent la déc[...]
La découverte du noyau
L’atome moderne : des électrons, un noyau et du vide … En 1911 Rutherford, Marsden et[...]
Ernest Rutherford
Ernest Rutherford, un découvreur de l’atome En octobre 1895, débarque en Angleterre un jeun[...]
Le neutron : Chadwick
Une compétition serrée entre grands chercheurs … James Chadwick, qui découvrit le neutron e[...]
Radium et médecine
Un peu d’Histoire : premiers pas de la médecine nucléaire … Tout le monde sait que la[...]
1934 : Radioactivité artificielle
Une découverte aux retombées majeures Dans les premiers jours de l’année 1934, Frédéric et [...]
L’hypothèse du neutrino
La remarquable histoire du neutrino Lors de la découverte des désintégrations radioactives[...]
La découverte de la fission
La physique échappe aux seuls physiciens 1939 : DÉCOUVERTE DE LA FISSION NUCLÉAIRE De 1934 à 1938[...]
Enrico Fermi
Un expérimentateur et un théoricien de génie Physicien italien, Enrico Fermi (Rome, 29 septembre [...]