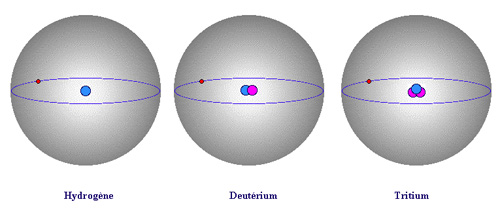
Exemple des trois isotopes de l’hydrogène
L’atome d’hydrogène a trois isotopes : l’hydrogène proprement-dit, le deutérium et le tritium. Le noyau du premier se réduit à un proton. Celui du deutérium est formé d’un proton et d’un neutron ; celui du tritium d’un proton et de deux neutrons. La charge électrique des trois noyaux est la même. La présence de neutrons ne modifie pas le comportement de l’électron unique qui gravite autour du noyau. Les propriétés chimiques sont identiques. Par contre, les atomes du deutérium et du tritium sont deux et trois fois plus lourds que l’hydrogène. Le deutérium est stable, mais rare. Le tritium est instable et radioactif.
© IN2P3
Présents dans le noyau mais dépourvus de charge électrique, les neutrons ne jouent aucun rôle pour le reste de l’atome et ses propriétés chimiques. En conséquence, deux atomes appartenant à une même espèce chimique peuvent différer par le nombre de neutrons dans leur noyau. De tels atomes sont appelés isotopes.
Un premier exemple est celui de l’hydrogène et de ses deux isotopes, le deutérium et le tritium. Comme les noyaux de ces trois atomes ne possèdent qu’un seul proton, ils n’ont qu’un seul électron de charge électrique négative en orbite de façon à préserver la neutralité électrique. Les propriétés chimiques des trois isotopes sont identiques, ainsi que les types de lumière qu’ils émettent et absorbent. Cependant, la masse d’un noyau d’hydrogène n’est que la moitié de celle d’un noyau de deutérium et le tiers de celle d’un noyau de tritium, les masses des protons et neutrons étant très voisines.
Un autre exemple est celui des isotopes du carbone. Un atome normal de carbone possède six électrons qui orbitent autour d’un noyau compact constitué de 6 protons et 6 neutrons. Les 6 électrons du cortège électronique ne sont en rien affectés par l’addition de neutrons qui ne change pas les charges électriques et les propriétés chimiques de l’atome. Le noyau peut devenir plus lourd ou moins lourd mais l’atome reste un atome de carbone.
Les diverses versions ou isotopes du même élément chimique se distinguent principalement par les propriétés de leurs noyaux. Bien que n’ayant pas d’effets sur les propriétés chimiques, un ajout ou retrait de neutrons peut avoir un effet substantiel sur le comportement du noyau. En modifiant le délicat équilibre entre protons et neutrons, ces ajouts ou retraits peuvent affecter la stabilité du noyau. Par exemple, l’isotope de carbone à 6 protons et 8 neutrons – le carbone-14 – produit couramment dans l’atmosphère par le rayonnement cosmique est instable et radioactif. La présence de carbone 14 dans des vestiges très anciens permet de les dater.
L’uranium naturel présent dans la croûte terrestre contient deux principaux isotopes : uranium 235 et uranium 238. Le premier n’est présent qu’au taux de 0.7 %, mais il est fissile et est utilisé dans les réacteurs nucléaires et les armes atomique. L’uranium 238 est peu fissile.
En pratique, presque tous les isotopes radioactifs ont disparu de nos existences. Les exceptions concernent ceux dont les durées de vie radioactives sont excessivement longues comme l’uranium, ceux qui sont produits en permanence et naturellement comme le carbone 14 et les descendants de l’uranium.
Parmi les atomes radioactifs produits par les hommes les principaux sont contenus dans les déchets radioactifs provenant des réacteurs nucléaires, et les radio-isotopes produits par des accélérateurs à des fins médicales.
Les autres articles sur le sujet « Le noyau atomique »
Proton
Le proton, le constituant du noyau avec une charge électrique positive Le noyau de l’atome [...]
Neutron
Le neutron, compagnon neutre du proton … Le neutron est avec le proton un des deux constitu[...]
Etats d’énergie du noyau
Analogie avec l’atome : des états d’énergie bien définis. Les noyaux sont a priori tr[...]
Quarks et leptons
Les constituants fondamentaux de la matière A l’échelle la plus élémentaire, le monde qui n[...]
Quarks et gluons
Comment les quarks interagissent au sein des noyaux … Pour décrire la radioactivité et des [...]
Matière et antimatière
La nature aime la symétrie. Or, on ne peut rêver d’une matière moins symétrique que celle q[...]