Délivrer le maximum de rayons dans la tumeur
La chirurgie, la chimiothérapie, et la radiothérapie (souvent utilisés en combinaison) sont les principales approches du traitement des cancers. Jusqu’à un passé récent, l’utilisation de la radioactivité à des fins thérapeutiques a été relativement limitée, la plus répandue étant celle de l’iode-131 pour les cancers de la thyroïde, en raison de l’affinité particulière de l’iode pour cette glande.
La plupart des procédures pour détruire les cancers délivrent les radiations au patient d’une manière externe, et pour cette raison sont appelées télé-thérapies. Des accélérateurs sont utilisés pour délivrer des électrons bêta ou encore des protons dans le volume cible, comme pour le traitement externe de la prostate ou celui du mélanome de l’œil. Bien que de tels traitements apportent des avantages substantiels, il est impossible d’empêcher les radiations de détruire ou d’endommager les tissus sains au voisinage des cellules malignes, spécialement quand les radiations doivent traverser des tissus sains pour les atteindre.
L’avantage d’utiliser des protons (protonthérapies) est que ces particules déposent beaucoup d’énergie en fin de parcours. En réglant l’énergie de ces protons accélérés, on peut faire en sorte que cette fin de parcours, donc le dépôt maximal d’énergie, ait lieu dans la tumeur. On peut également remplacer les protons par des noyaux légers, comme des ions carbone (hadronthérapies) dont le pouvoir destructeur des tumeurs est plus important.
Deux autres approches pour réduire les dommages aux cellules saines consistent à : créer des radio-isotopes sur le site de la tumeur ; délivrer directement au tissu cancéreux les radio-isotopes appropriés.
Thérapies avec des neutrons
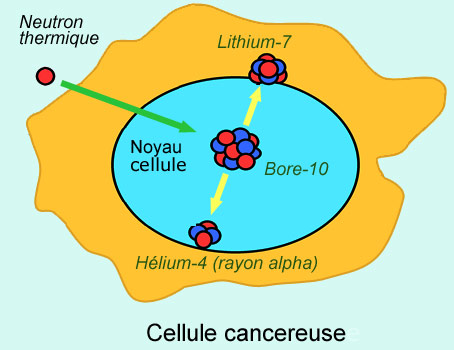
Le bore-10 est un noyau atomique fragile. Quand il capture un neutron, il se fissionne en deux noyaux de lithium-7 et d’hélium-4 (particule alpha). La probabilité de capture d’un neutron thermique par ce bore est beaucoup plus élevée que celles d’autres éléments. Si par l’intermédiaire d’un produit radio-pharmaceutique, ce bore est introduit au sein d’une cellule cancéreuse, sa fission par un neutron provoquera la mort de cette cellule. Les deux fragments de cette fission ont un fort pouvoir destructeur, car ils déposent toute leur énergie au sein de la cellule.
© IN2P3
Un exemple de la première approche est la thérapie par capture de neutrons par le bore (BNCT ou Boron-Neutron Capture Therapy en anglais). Le bore est introduit dans le patient par l’intermédiaire d’un support chimique qui se concentre sur le site de la tumeur. Les noyaux de bore ont la propriété de capturer préférentiellement des neutrons, à la suite de quoi ils se fragmentent en émettant des rayons alpha. On focalise donc un faisceau de neutrons sur la tumeur, de façon à produire des alpha qui détruisent les cellules malignes situées à proximité.
Les alpha étant stoppés après un très court parcours ( de la taille d’une cellule), le dommage de la radiation est intense et très localisé. On ne peut éviter les dommages collatéraux causés par les neutrons dans les cellules saines traversé pour atteindre la zone maligne, mais on peut réduire cet inconvénient. La BNCT est par exemple pratiquée auprès du réacteur de recherches de Petten en Hollande.
Un exemple de la seconde approche (délivrer directement au tissu cancéreux les radio-isotopes appropriés) est la thérapie directe des cellules à partir d’émetteurs radioactifs implantés dans le tissu. Pour des tumeurs « solides » une façon d’introduire le radio-isotope dans la cible est l’injection directe si la cible est accessible. Un exemple est la curiethérapie dont une application récente est le traitement des cancers de la prostate. Une dose adéquate d’émetteurs gamma et X comme l’iode-125 ou le palladium-103 sont encapsulés dans de petites capsules de titane de la taille d’un grain de riz. Ces implants sont alors placés directement dans la glande de la prostate où elles demeurent pour le reste de la vie.
Une autre technique de thérapie directe des cellules est celle du smart bullet (ou du boulet astucieux ». Elle consiste à trouver un corps chimique qui a une attirance spéciale pour les cellules malignes et à attacher un radio-isotope à ce porteur. L’approche est particulièrement adaptée aux traitements de cellules malignes qui ne sont pas localisées comme les leucémies ou les maladies de Hodgkin. Des travaux récents employant cette technique ont montré des résultats impressionnants. Des maladies de Hodgkin en phase terminale traitées avec l’yttrium-90, un émetteur bêta, ont montré un taux de réponses positives dépassant 80 %. Des essais récents utilisant un émetteur alpha (Bismuth-213) ont abouti à des résultats remarquables dans le traitement de leucémies.
Les articles sur le sujet « Radiothérapie Avancée »
Curiethérapies
La plus ancienne thérapie nucléaire aujourd’hui modernisée La Curiethérapie est la plus anc[...]
Curiethérapie de la prostate
Une destruction efficace de cellules cancéreuses On observe depuis les années 2000, en particulie[...]
Radiothérapies métaboliques
Des radioisotopes en interne à but thérapeutique Les applications des radioisotopes en médecine n[...]
Protonthérapies
La protonthérapie : une radiothérapie aboutie et de précision La protonthérapie consiste à traite[...]
Hadronthérapies
Autres thérapies nucléaires avancées … Les hadrons sont des particules élémentaires dont le[...]