Des doses locales importantes
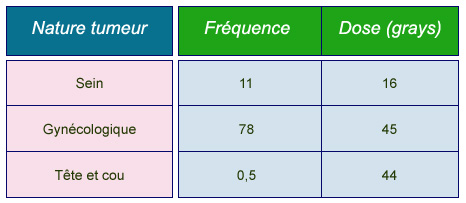
Fréquences et doses en curiethérapies
Fréquence annuelle moyenne des curiethérapies les plus courantes données et doses typiques prescrites. Les fréquences sont données par million d’habitants pour les pays du groupe I bénéficiant des système de soins les plus avancés (Health Care I countries). (Source : K.G. Gerber/Unscear 2000).
© IN2P3
En dehors de la radiothérapies, les rayonnements utilisés sont d’origine radioactive ou nucléaire. Dans ces thérapies, les doses délivrées à la tumeur sont de quelques dizaines de grays. Elles sont considérables comme en radiothérapie ordinaire car il s’agit de détruire des cellules malignes. L’objectif reste identique même si le mode d’administration des rayons est différent : arriver au but thérapeutique en minimisant les dommages aux tissus sains.
Il convient de distinguer entre thérapie métabolique – la plus pratiquée – et la curiethérapie. Dans les deux cas, il s’agit d’expositions internes.
Une caractéristique des curiethérapies est que les doses reçues sont concentrées près de la tumeur, là où les sources sont introduites. Par exemple, dans une curiethérapie du sein, les rayons bêta déposeront leur dose à proximité immédiate des fils d’iridium-192. On préférera une curiethérapie si la tumeur est bien localisée et des rayons si la tumeur est diffuse.
Dans une thérapie métabolique – dont la plus fréquente est celle de la thyroïde par l’iode-131 – le vecteur et l’élément radioactif sont choisis pour se fixer de préférence sur la tumeur du fait de l’affinité chimique de la thyroïde pour l’iode. Ce seront à nouveau les rayons bêta émis qui seront à l’origine de la dose.
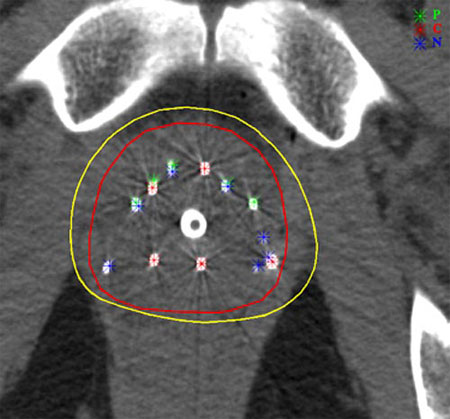
Implants pour les cancers de la prostate
Les curiethérapies de la prostate à l’aide d’implants d’iode-125 ou de palladium-103 sont à l’origine d’irradiations locales intenses de l’ordre de 100-150 Gy (grays)- mais très localisées et étalées dans le temps. A l’intérieur de la ligne en jaune (isodose 160 Gy), la densité de dépôt d’énergie dépasse 160 grays. Cette zone de forte irradiation épouse bien le contour de la prostate (ligne en rouge).
© Kimmel Cancer Center at Jefferson
L’administration d’un isotope radioactif pour le traitement d’un cancer se fait généralement en une seule fois, sous la forme d’une forte dose d’activité. Les période radioactives et biologiques du radioélément sont relativement courtes de façon à garantir la disparition relativement rapide de l’élément radioactif dans l’organisme du patient. Les doses d’activité injectées étant très fortes, elles nécessitent d’être évaluées avec précision pour que le risque reste acceptable.
Les doses absorbées sont évaluées à partir de calculs complexes du type MIRD (initiales anglaises de Medical Internal Radiation Dose) ou des méthodes dosimétriques simplifiées prenant en compte l’âge, le sexe et d’autres facteurs.
L’administration au patient d’une forte activité d’isotopes radioactifs présente aussi un risque pour le personnel soignant et l’entourage.
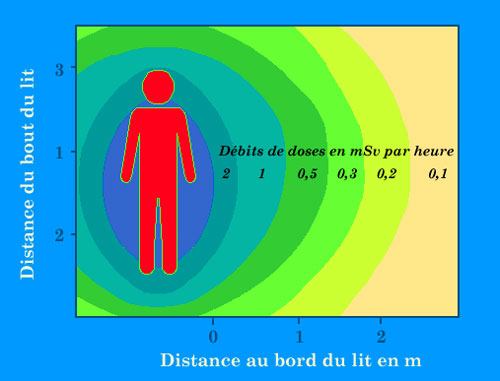
Chambres protégées
Débits de doses approximatifs autour du lit d’un patient auquel on vient d’injecter une activité de 3700 MBq de cesium-137 ou 5500 MBq d’iode-131. La curiethérapie à bas débit et la thérapie métabolique nécessitent de disposer de chambres protégées pour l’hospitalisation des patients porteurs de sources. En curiethérapie, la protection des chambres est déterminée sur la base d’une source de césium 137 de 8200 MBq ou d’iridium 192 de 5600 MBq, placée au centre du lit du malade.
© IN2P3
Les rayons gamma qui accompagnent la plupart des désintégrations radioactives sont beaucoup plus pénétrants que les bêta. Ces gamma irradient aussi le personnel soignant présent à longueur d’année. Quand une forte dose est injectée, par exemple 5000 MBq ( 0,135 millicurie) d’iode-131 pour le traitement d’une hyperthyroïdie, une chambre blindée est nécessaire où le temps de présence de personnel hospitalier est strictement limité et le port de dosimètres obligatoire.
L’élimination de l’iode se fait selon deux modes. Les 30 % qui se sont fixés dans la thyroïde (30%) sont éliminés avec une période biologique d’environ 13 heures. Les 70% répartis dans l’organisme en dehors de la thyroïde s’élimine majoritairement par voie rénale, c’est à dire par les urines.
Les autres articles sur le sujet « Expositions en médecine »
Dosimétrie des examens
De la simple radiographie aux scintigraphies et examens TEP Les examens de médecine nucléaire de [...]
Doses : scanners et rayons X
Radioprotection médicale : expositions en radiodiagnostic La très grande majorité des diagnostics[...]
Doses en scintigraphies et TEP
Radioprotection médicale : doses en diagnostic nucléaire Les examens de médecine nucléaire ne son[...]
Doses en radiothérapies
Thérapies : de fortes doses mais locales Les thérapies proprement nucléaires (curiethérapies, thé[...]
Risques secondaires
S’exposer aux rayons ou laisser évoluer le cancer … Depuis plus de 20 ans, on assiste[...]