Histoire de la Radiothérapie
Des rayonx X à la radiothérapie moderne
Les découvertes des rayons X par W.K. Rœntgen en 1895 et de la radioactivité par H. Becquerel en 1896 sont à l’origine de la radiothérapie. Après ces découvertes, les effets des rayonnements ionisants sur la matière vivante ont été observés. Leur potentiel pour le traitement de certaines affections de la peau (tumeur cutanée, teigne…) ou de tumeurs peu profondes a rapidement été alors exploité.
Très vite après la découverte en 1896 de la radioactivité, Henri Becquerel observa que le tube de radium qu’il portait dans sa poche de son gilet provoquait une irritation de sa peau. Dans les mêmes conditions, Pierre Curie provoqua sur son bras une irritation identique. C’était en 1901. Aussitôt il pressentit l’intérêt de la radioactivité pour traiter les tumeurs. Après sa mort, Marie Curie et Claudius Régaud associèrent la physique, la chimie et le biomédical et devinrent les pionniers d’une nouvelle thérapie.
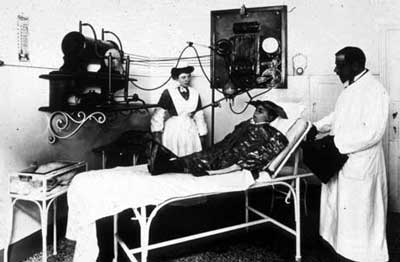
Radiothérapie en 1925
Installation de radiothérapie en Italie vers 1925. Il s’agit de soigner ce jeune malade de la teigne. On aperçoit l’installation de rayons X à gauche au-dessus du lit. Lors de l’irradiation, des rayons X sont rayonnés dans toute la salle. Peu de précautions sont prises. On ne dispose pas de moyens pour concentrer efficacement les rayons sur la partie à soigner et réduire l’irradiation des tissus sains.
© Institut Curie
La radiothérapie utilisa à ses débuts les rayons X émis par le radium ou ceux produits par des différences de potentiel pouvant atteindre 200kV (à peine plus élevé que ceux utilisé pour les clichés radiologiques). La faible pénétration de ces rayons dans les tissus (de l’ordre de 5cm) limita longtemps la radiothérapie au traitement des tumeurs cutanées, du sein, de certaines localisations ORL ou à des traitements palliatifs et antalgiques. D’autre part, la collimation des rayons n’était pas efficace et les traitements peu précis en terme de ciblage.
Il fallut attendre les années 50 et plus précisément 1955 avec l’arrivée des appareils de télécobalthérapie, les bombes au cobalt, pour observer de véritables progrès dans le domaine. L’énergie moyenne des rayonnements émis par le Cobalt 60 est de 1,25 MeV ce qui augmente considérablement la pénétration des rayons dans les tissus. Des collimateurs furent également installés sur les appareils afin de mieux cibler l’émission des rayons dans la tumeur et d’épargner les tissus sains. Le cobalt 60 fut créé artificiellement. Il était beaucoup plus accessible que le radium et les applications de la radiothérapie externe se multiplièrent dès lors.
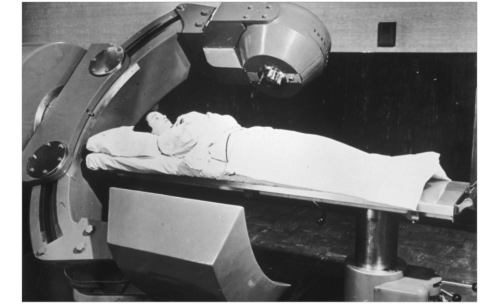
Cobalt 60 Cancer Therapy Description:
Shows photo of person receiving Cobalt 60 cancer therapy.
© National Museum Of American / Slide Source : G. Terry Sharrer, Ph.D. /
A la fin des années 60, apparaissent les premiers accélérateurs linéaires d’électrons. Les électrons de haute énergie produits peuvent être utilisés directement. Leur pénétration dans les tissus est alors limitée aux premiers centimètres. Ils peuvent également (et à partir de la même machine) être dirigés vers une cible (généralement composée de tungstène) pour produire, par rayonnement de freinage, un rayonnement de photons de haute énergie (de 6 à 25 MeV en fonction de l’énergie initiale des électrons). La collimation de ces particules est largement améliorée (avec l’arrivée du collimateur multi-lames (ou MLC) en 1965) et les faisceaux de plus en plus fins permirent de considérablement améliorer le ciblage des volumes à traiter.
En 1974, apparut la tomodensitométrie (ou imagerie scanner) qui conduisit à une autre révolution dans le domaine de la radiothérapie avec la naissance de la Radiothérapie Conformationnelle 3D (RC3D). Cette technique repose sur l’imagerie à trois dimensions de la tumeur et des organes avoisinants. Le contour des faisceaux est ajusté à la forme de la tumeur, de manière à minimiser la dose reçue par les tissus sains avoisinant. En ajustant ainsi la balistique de l’irradiation (forme, nombre, incidence et énergie des faisceaux), on réduisait considérablement les effets secondaires de la radiothérapie.
Le développement de l’informatique et de planification des traitements (appelés TPS pour Treatment Planning Systems) dans les années 90, permettra ensuite de réaliser un calcul tridimensionnel de la dose et donc de planifier les traitements de manière beaucoup précise en fonction de l’anatomie propre à chaque patient et de contraintes de doses à ne pas dépasser sur certains Organes ARisque (OARs).
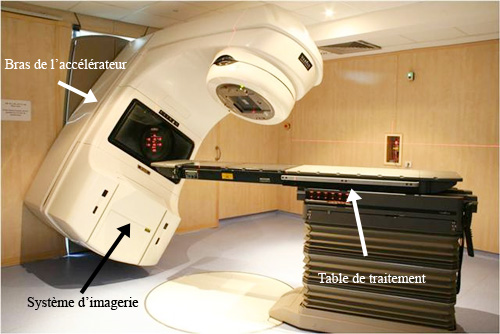
Radiothérapie moderne
On mesure sur cette installation moderne le chemin parcouru en radiothérapie. La photographie montre un accélérateur linéaire de dernière génération, qui remplace maintenant les bombes au cobalt dans les hôpitaux. Un avantage de ces appareils est de pouvoir diriger les rayons sur les tumeurs à traiter
© Institut Curie
Au début des années 2000, les traitements se modernisent encore avec l’apparition de la Radiothérapie Conformationnelle avec Modulation d’Intensité (RCMI ou IMRT en anglais). L’intensité du rayonnement n’est plus constante à l’intérieur d’un même faisceau, mais modulée à l’aide du mouvement continu des lames du MLC et de la variation du débit de photons. Cette technique est indiquée dans le traitement de certains cancers (prostate et ORL notamment). Elle permet principalement de mieux épargner les tissus sains localisés autour de la tumeur. L’IMRT se décline aujourd’hui sous différentes solutions techniques : VMAT, Tomothérapie, Cyberknife, Véro…
En cent ans, la « radiothérapie externe» (utilisant des rayonnements ionisants de diverses origines) a atteint un haut degré de sophistication technique. Utilisée chez un malade sur deux (soit plus de 100 000 patients par an), elle s’intègre actuellement dans des stratégies thérapeutiques complexes associant la chimiothérapie et les interventions chirurgicales.
Les appareils de télécobalthérapie (les bombes au cobalt) sont interdits en France depuis 2010 (essentiellement pour des raisons de radioprotection : difficulté de mise en place et de traitement des sources dont le débit est devenu trop faible pour une utilisation clinique), laissant entièrement place aux accélérateurs linéaires d’électrons.
COMPLEMENT HISTORIQUE: Radium et débuts de la médecine nucléaire
Les autres articles sur le sujet « Radiothérapie Classique »
Préparation du traitement
Une préparation soignée aux multiples étapes Après l’établissement du diagnostic et de la prescri[...]
Production des rayonnements
Généralement des rayons gamma issus d’un petit accélérateur Le plus souvent, le rayonnement[...]
Planification du traitement
Une nécessité pour les traitements de radiothérapie modernes Le système de planification de trait[...]
Radiothérapie Conformationnelle RC3D
La Radiothérapie Conformationnelle 3D (RC3D) La Radiothérapie Conformationnelle 3D (RC3D) est née[...]
Radiothérapie Conformationnelle RCMI
Radiothérapie Conformationnelle avec Modulation d’Intensité (RCMI) La Radiothérapie Conformationn[...]