Radiothérapies métaboliques
Des radioisotopes en interne à but thérapeutique
Les applications des radioisotopes en médecine nucléaire ne se limitent pas à la scintigraphie ou à la tomographie par émission de positons. Des émetteurs bêta-moins (voire alpha) sont utilisés à but thérapeutique, curatif ou palliatif : c’est la « radiothérapie métabolique« , encore appelée « radiothérapie interne vectorisée » ou RIV. En raison de leur court parcours dans la matière vivante, ces rayonnements contrairement aux rayons gamma, restent confinés dans l’organe à soigner ou la tumeur à détruire.
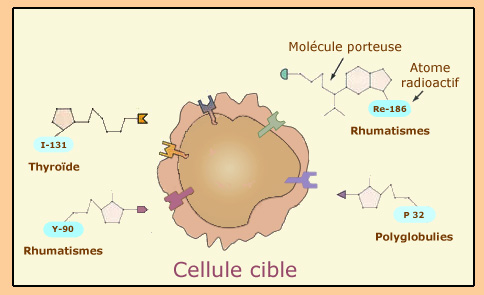
Cibler les cellules
En thérapie métabolique, il s’agit de cibler les cellules malades avec des produits radiopharmaceutiques appropriés. Des atomes radioactifs sont administrées au patient par l’intermédiaire d’une molécule porteuse ayant des affinités avec ces cellules. Une fois la molécule assimilée, l’atome radioactif se retrouve directement au contact de la cellule. Quand il se désintègre, l’électron bêta émis dépose son énergie par ionisation à l’intérieur de celle-ci. Les dégâts produits par ionisation provoque sa destruction.
© IN2P3
Comme dans le cas de l’imagerie scintigraphique, un produit radiopharmaceutique est administré au patient. Le but principal n’est pas de réaliser une image mais de délivrer une dose élevée (supérieure à 50 Grays) dans un volume cible, bien que le rayonnement bêta soit souvent accompagné d’un rayonnement gamma permettant la localisation.
En conséquence, les activités administrées au patient pour une thérapie sont très supérieures à celles administrées pour un diagnostic.
Les doses significatives sont exprimées en grays. Elles représentent un dépôt d’énergie par unité de volume. Ce sont des doses locales délivrées à la tumeur qui ne doivent pas être confondues avec la dose efficace – exprimée en millisieverts – qui mesure la dose reçue pour le « corps entier ».
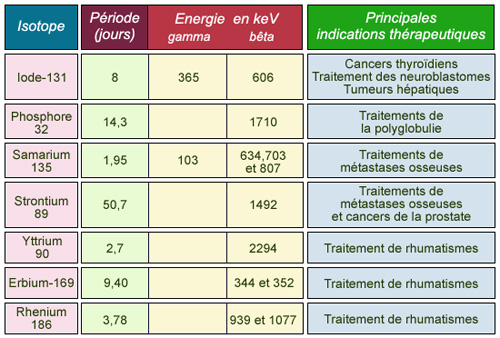
Radio-isotopes en thérapies métaboliques et applications
Table des radio-isotopes utilisés pour les thérapies métaboliques : périodes radioactives, énergie des rayonnements émis et applications.
© IN2P3
L’iode-131 est depuis longtemps utilisé pour le traitement des hyperthyroïdies et des cancers thyroïdiens après intervention chirurgicale. Les activités administrées au patient sont très importantes et induisent donc une hospitalisation du patient dans des chambres individuelles (appelées chambres protégées). Pendant la durée du traitement, des dispositions spéciales en matière de radioprotection sont prises (recueil séparé des urines du patient, interdiction des visites, limitation de l’exposition du personnel soignant).
L’yttrium-90, l’erbium-169 et le rhénium-186 sont utilisés pour le traitement de rhumatismes par injection intra-articulaire. Ces traitements ne nécessitent pas l’hospitalisation du patient car ce sont des radioéléments bêta purs, qui n’émettent pas de rayons gamma qui pourraient poser des problèmes pour l’entourage.
Alphathérapies ciblées.
On s’intéresse également aujourd’hui à des thérapies ciblées utilisant des émetteurs alpha. Elles présentent divers avantages : l’énergie des particules alpha beaucoup plus élevées que celles des électrons bêta ; leur pouvoir ionisant est environ 1000 fois supérieur. La totalité de l’énergie d’une particule alpha sera déposée sur une distance de 100 µm (microns), alors que l’énergie d’un bêta le sera sur une distance de 2 à 3mm. La taille d’une cellule avoisinant 20 µm, les cellules cancéreuses seront particulièrement vulnérables aux particules alpha qui les traversent, au point que la destruction d’une cellule cancéreuse peut résulter de l’action d’une seule particule alpha. Cette plus grande efficacité permet de diminuer la quantité injectée.
Les émetteurs alpha ouvrent d’intéressantes possibilités pour le traitement de cancers pour lesquels il existe encore peu de solutions comme le cancer du pancréas ou celui des ovaires. Cependant, ceux dont les caractéristiques conviennent sont peu nombreux. L’un deux est le bismuth 212. Sa période radioactive de 61 minutes est un peu courte, mais il est produit par la désintégration bêta d’un noyau précurseur de plomb 212 dont la période radioactive est de 10,6 heures. C’est ce plomb-212 précurseur qui est injecté dans le corps humain donnant naissance au bismuth-212 qui agirait sur la cellule.
Il est nécessaire de pouvoir cibler précisément les cellules tumorales à traiter. L’alphaimmunothérapie repose sur l’association du radioélément avec un anticorps dont l’antigène se trouve à la surface des cellules tumorales ciblées. Un tel ligand (TCMC) a été trouvé pour le plomb-212. Le complexe chimique dont fait partie l’atome radioactif reconnait les antigènes présents à la surface des cellules cancéreuses. Une fois dans la cellule, le plomb se transforme en bismuth dont le rayon alpha engendre la mort de la cellule.
Pour l’alphathérapie ciblée à base de plomb-212, il faut disposer d’installations de radiochimie à même d’extraire ce descendant du thorium naturel avec une grande pureté. La société AREVA (devenue ORANO) qui dispose de ces installations et du savoir faire est à la pointe en France des recherches sur cette thérapie (ORANO MED). En février 2024, ORANO MED lance la construction d’un laboratoire pour ce mode d’alphathérapie. Ce laboratoire, situé à Onnaing près de Valenciennes, sera en Europe le premier établissement pharmaceutique dédié à la production de radiothérapies internes au plomb-212.
Les autres articles sur le sujet « Radiothérapie Avancée »
Curiethérapies
La plus ancienne thérapie nucléaire aujourd’hui modernisée La Curiethérapie est la plus anc[...]
Curiethérapie de la prostate
Une destruction efficace de cellules cancéreuses On observe depuis les années 2000, en particulie[...]
Protonthérapies
La protonthérapie : une radiothérapie aboutie et de précision La protonthérapie consiste à traite[...]
Hadronthérapies
Autres thérapies nucléaires avancées … Les hadrons sont des particules élémentaires dont le[...]