Un radioélément produit dans l’atmosphère utilisé pour la datation
Le noyau de carbone-14 contient 6 protons et 8 neutrons (au lieu de 6 pour le carbone-12 ordinaire). Cet isotope du carbone est radioactif, sa période est de 5700 ans et il émet des électrons bêta.
Le carbone-14 est constamment régénéré par les rayons cosmiques de l’atmosphère. Le rythme de sa formation est pratiquement constant à l’échelle de quelques siècles. Il dépend du flux des particules en provenance de l’espace qui bombarde la terre et du champ magnétique terrestre qui nous protège en partie contre ce bombardement. Ce flux et ce bouclier évoluent très lentement avec le temps. La quantité de cet isotope du carbone suit cette lente évolution, car un équilibre étant atteint, il se forme à chaque instant autant de ce noyau qu’il s’en désintègre.
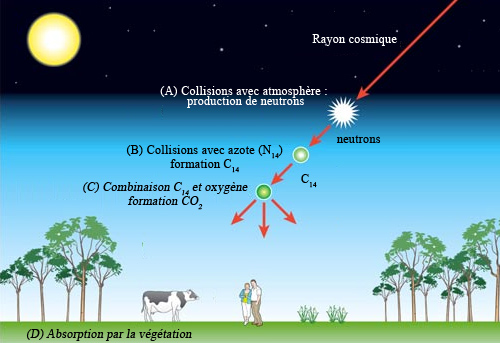
Etapes de la formation du carbone-14
Le carbone-14 est généré en continu dans l’atmosphère par le rayonnement cosmique. Des neutrons sont éjectés de noyaux de la haute atmosphère lors de collisions avec des rayons cosmiques (A). Capturés par des noyaux d’azote (N-14), les neutrons transforment ces noyaux en carbone-14 (B). Les atomes de carbone-14 s’unissent avec l’oxygène de l’air pour former du gaz carbonique (C). Finalement le CO2 à base de radiocarbone, absorbé par la végétation, s’insère dans l’environnement (D).
© IN2P3
La formation du carbone-14 est due aux rayons cosmiques. Les collisions de ces particules avec les noyaux de la haute atmosphère libèrent des neutrons. Ces neutrons interagissent à leur tour avec les noyaux d’azote de l’air provoquant des réactions nucléaires. Le noyau d’azote comporte 7 protons et 7 neutrons. Dans la réaction conduisant au carbone-14, le neutron remplace un des protons de l’azote qui est éjecté, selon la réaction :
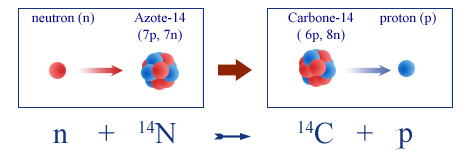
© Formation du carbone 14 à partir de l’azote de l’air
IN2P3
Le gaz carbonique formé à partir du carbone-14 est chimiquement identique au gaz carbonique normal. L’isotope radioactif est absorbé par les végétaux et les êtres vivants comme du carbone ordinaire à raison d’un atome pour mille milliards (10 puissance 12) d’atomes de carbone ordinaire.
Il se retrouve dans cette infime proportion à l’intérieur de tous les composés du carbone et dans la matière vivante dont le carbone est l’un des constituants. Pour cette raison, le carbone-14 est co-responsable, avec le potassium-40, de la radioactivité du corps humain.
Environ 3000 noyaux de carbone-14 s’y désintègrent par seconde. Ces 3000 désintégrations correspondent à 768 milliers de milliards d’atomes présents en nous. Ce chiffre pourrait nous impressionner, mais il correspond à 18 milliardièmes de gramme (le calcul a été fait pour un homme de 80kg), une broutille ! Le nombre d’Avogadro est passé par là !
À la mort d’un organisme vivant, l’isotope radioactif n’est plus absorbé et sa proportion, décroît avec le temps. La quantité de Carbone-14 subsistant dans un échantillon ayant appartenu à cet organisme est utilisée pour dater cet organisme.
Ce radioélément est également utilisé comme marqueur radioactif.
Applications de la datation au carbone-14 – Article RGN, juin 2020
Les autres articles sur le sujet « Principaux noyaux »
Uranium
L’uranium-235 : le seul noyau fissile existant à l’état naturel L’atome d&rsquo[...]
Plutonium-239
Plutonium-239 : un noyau fissile artificiel, redouté et recherché Quatre-vingt-quatorzième élémen[...]
Le radium
Le premier atome radioactif découvert Le radium, élément extrêmement rare, fut découvert par Pier[...]
Tritium
Une variante lourde et radioactive de l’hydrogène Le tritium est un isotope radioactif de l[...]
Le potassium-40
Un noyau à vie très longue et deux modes de désintégration Le potassium-40, que l’on trouve[...]
L’Iode-131
Un isotope radioactif de l’iode qui se concentre dans la thyroïde L’iode-131 est un é[...]
Césium 137
Un radio-isotope important de 30 ans de période Le césium-137 est un élément radioactif dont la d[...]
Strontium-90
Un produit de fission proche du calcium Le strontium-90 est avec le césium-137 un des principaux [...]
Technétium-99
Tous les atomes du tableau de Mendeleïev jusqu’à l’uranium sont présents dans notre e[...]