Le plus connu des corpuscules élémentaires
L »électron est un corpuscule qui joue un rôle fondamental dans toutes les branches de la Science et dans notre vie quotidienne. Sa découverte en 1897, par le Physicien anglais Joseph John Thomson marque un tournant dans notre compréhension de la nature. Elle précèdera de peu celle de la radioactivité.
Thomson essayait de comprendre la nature des rayons cathodiques, des rayons qui étaient émis par la cathode des « tubes à rayons cathodiques », les ancêtres de nos télévisions avant l’arrivée des écrans plats.
De ces observations, Thomson déduisit la nature corpusculaire des rayons cathodiques. Il mesura le rapport de la masse et la charge de ces corpuscules et en déduisit qu’ils étaient au moins 1000 fois plus légers que l’ion d’hydrogène (le proton), l’objet le plus léger alors connu.
1897 : découverte de l’électron par J.J. Thomson
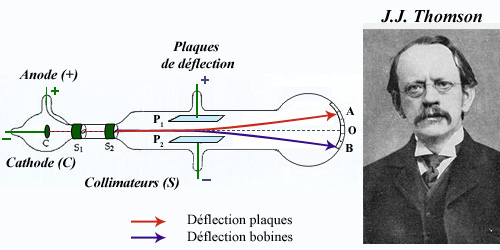
Dans le tube à rayons cathodiques de Thomson, le vide a été fait. La cathode (C ) est à un potentiel négatif de quelques centaines de volts, l’anode étant reliée à la terre. Les rayons se dirigent vers l’anode et traversent deux fentes S.pour frapper en ligne droite l’extrémité du tube au point O. En appliquant un champ électrique entre les deux plaques P1 et P2 les rayons cathodiques étaient déviés vers le haut selon le chemin indiqué en rouge. Un champ magnétique appliqué avec une bobine, déviait également les rayons cathodiques. De ces observations, Thomson déduisit la nature corpusculaire des rayons cathodiques.
© IN2P3
L’électron est encore plus léger que ne l’avait mesuré Thomson : sa masse n’est que le mille huit cent trente septième de celle d’un proton. Le cortège atomique des électrons pèse encore moins lourd par rapport au noyau de l’atome qui est alourdi de neutrons. Les physiciens nucléaires préfèrent utiliser, plutôt les masses qui sont infinitésimales mesurées en grammes, les énergies de masse. L’énergie de masse mc² de l’électron (sa masse multipliée par la vitesse de la lumière au carré) vaut 511 keV.
La charge électrique de l’électron est la plus petite charge électrique connue. Par définition elle est négative. Sa valeur est notée e. Toutes les charges électriques, hormis celles des quarks, sont des multiples de cette charge e considérée comme élémentaire.

Masse et charge électrique de l’électron
La masse et la charge électrique de l’électron exprimées en gramme et en coulombs sont données par des chiffres extrêmement petits ; 0,911 et 1,6 précédés de 27 et 19 zéros.
© IN2P3
L’électron est un constituant élémentaire de la matière comme les quarks appelés up et down, les constituants des protons et neutrons. Il appartient avec ces derniers et le neutrino électron à la première génération des constituants fondamentaux de la matière. Il est le seul à pouvoir être observé facilement, les quarks étant confinés dans les noyaux et les neutrinos quasi impossibles à détecter.
L’électron, comme les quarks et le neutrino constituent les plus petites toupies que l’on puisse imaginer. Ils possèdent deux états de rotation possibles ou spin, l’intensité de cette rotation étant unique et la plus petite que l’on connaisse. Le grand physicien italien Enrico Fermi a formulé le premier la théorie de ces corpuscules à deux états de rotation comme l’électron, mais aussi les quarks, les protons et neutrons. Ils sont appelés fermions en son honneur.
Les fermions sont soumis à une règle appelée le principe d’exclusion de Pauli. Le principe de Pauli dit que deux électrons ne peuvent être dans un même état (appelé quantique). Il joue un très grand rôle dans l’atome. Sans lui, le cortège des électrons, attirés par sa charge électrique, s’écraseraient sur le noyau.
Selon le principe de Pauli, deux électrons seulement peuvent partager l’espace le plus proche du noyau, l’un tournant dans un sens, l’autre dans le sens opposé, car ils sont distingués par leur sens de rotation. Un troisième électron, ne pourra partager cet espace, car les deux états de spin sont pris. Il devra choisir un territoire plus éloigné. Ce territoire plus éloigné – que les atomistes appellent couche L – peut accueillir jusqu’à 8 électrons. Ainsi se construisent couche après couche les atomes entourés du cortège électronique volumineux que nous connaissons.

Spin de l’électron
Enrico Fermi ( 1901-1954) et Paul Dirac (1902-1984) ont formulé la théorie du comportement des fermions, ces corpuscules qui peuvent avoir seulement deux états de rotation ou spin par rapport à un axe : l’un de rotation dite gauche, l’autre étant dite droite. Ainsi, les électrons qui ne peuvent être dans un même état quantique, selon la théorie de Fermi-Dirac s’organisent en un volumineux cortège électronique autour du noyau de l’atome.
© IN2P3
Les électrons ne se contentent pas de transporter l’électricité. Ils sont présents partout, en physique, en chimie, en biologie. C’est en partageant les électrons périphériques de leurs cortèges que les atomes s’assemblent en molécules. Toute la chimie ou presque est affaire d’électrons.
En radioactivité, l’électron intervient dans trois phénomènes, dont le principal est le premier :
– L’émission d’un électron du noyau, radioactivité bêta ;
– La capture d’un électron atomique par le noyau : la capture électronique ;
– L’éjection d’un électron du cortège atomique par un gamma issu du noyau : la conversion interne.
SUITE : Un électron lourd et instable, le muon
Voir aussi :
Neutrino-électron
Electron positif ou positron
Radioactivite bêta (β)
La capture électronique
Conversion Interne
October 1897: The discovery of the electron
Les autres articles sur le sujet « Le monde atomique »
L’atome
Une masse concentrée dans le noyau et beaucoup de vide … L’atome est souvent représen[...]
Niveaux d’énergies
Une structure en couches …. La conquête de l’espace nous a habitué aux mouvements d’un sate[...]
Photons
Les minuscules constituants de la lumière et des ondes électromagnétiques La lumière est composée[...]
Ordres de grandeur
Le très petit … et le très grand L’atome et plus encore le noyau appartiennent au monde de [...]
Le nombre d’avogadro
Des milliers de milliards de milliards d’atomes …. La contrepartie de l’extrême[...]
Einstein : E = Mc²
Masse et énergie interne d’une particule Les énergies dégagées dans les réactions chimiques[...]
Échelle des énergies
Une gamme d’énergies pour l’infiniment petit … L’unité d’énergie considérée pou[...]