Une masse concentrée dans le noyau et beaucoup de vide …
L’atome est souvent représenté comme un système solaire miniature quand il est question de lui. Cette image remonte au premier modèle moderne que proposa le physicien danois Niels Bohr en 1913. Elle est trompeuse, car l’atome est en réalité plus compliqué ; ses constituants, noyaux et électrons, obéissent en effet aux lois de la mécanique quantique.
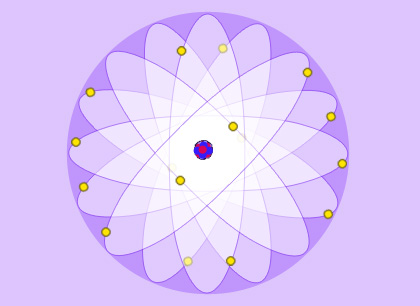
Un atome composé de vide
L’image familière de l’atome avec ses électrons tournant comme des planètes autour du noyau est plaisante mais assez éloignée de la réalité. Elle rend toutefois compte du fait que toute la matière, ou presque, se retrouve concentrée dans un minuscule noyau. Le reste est composé de vide ou circulent des électrons deux mille fois plus légers. Le noyau est environ cent mille fois plus petit que l’atome. Les électrons ne décrivent pas des orbites mais se partagent l’espace autour du noyau.
© IN2P3
Les atomes sont constitués d’un cortège d’électrons gravitant autour d’un noyau environ 100 000 fois plus petit.
Les électrons sont de minuscules corpuscules dotés d’une charge électrique négative -e qui est la plus petite charge électrique connue. Toutes les charges électriques observées sont un multiple entier positif ou négatif de cette charge e qui est appelée élémentaire. Il existe cependant une exception. Les charges électriques des quarks, les constituants élémentaires des protons et neutrons sont égales à 2e/3 ou -e/3. Elles sont dites fractionnaires.
Le nombre d’électrons, qui va de 1 à une centaine, définit le numéro atomique de l’atome neutre, c’est-à-dire qui n’a pas capturé ou perdu d’électrons (comme on le verra plus loin ce nombre est égal au nombre de protons Z du noyau). L’atome le plus simple, un atome d’hydrogène comporte un seul électron. L’atome d’oxygène en comporte par exemple 8. Les électrons des couches les plus externes sont responsables des propriétés chimiques de l’atome.
La charge électrique du cortège d’électrons est exactement compensée par une charge électrique positive présente dans le noyau. Cette charge est due à la présence de corpuscules, les protons, porteurs d’une charge électrique égale et opposée à celle de l’électron. Il y a autant d’électrons que de protons dans le noyau. L’atome est donc électriquement neutre.
A côté des protons, on trouve également dans le noyau, en nombre sensiblement équivalent, des neutrons, particules semblables aux protons mais dépourvues de charge électrique.
On appelle nucléons les constituants du noyau: protons et neutrons. Les nucléons sont environ deux mille fois plus lourds que l’électron, si bien que la masse de l’atome et du noyau sont pratiquement égales. L’essentiel de la masse de l’atome se trouve donc concentrée dans le volume infime du noyau, dont la densité atteint des valeurs faramineuses. Des physiciens ont évalué à 230 000 tonnes par millimètre cube la densité de la matière nucléaire.
Le nombre de nucléons A est appelé nombre de masse. Les masses des atomes sont en proportion de ce nombre. C’est pourquoi un atome d’oxygène (A=16) pèse a peu de choses près 16 fois plus lourd qu’un atome d’hydrogène (A=1).
Les autres articles sur le sujet « Le monde atomique »
Electron
Le plus connu des corpuscules élémentaires L »électron est un corpuscule qui joue un rôle fondame[...]
Niveaux d’énergies
Une structure en couches …. La conquête de l’espace nous a habitué aux mouvements d’un sate[...]
Photons
Les minuscules constituants de la lumière et des ondes électromagnétiques La lumière est composée[...]
Ordres de grandeur
Le très petit … et le très grand L’atome et plus encore le noyau appartiennent au monde de [...]
Le nombre d’avogadro
Des milliers de milliards de milliards d’atomes …. La contrepartie de l’extrême[...]
Einstein : E = Mc²
Masse et énergie interne d’une particule Les énergies dégagées dans les réactions chimiques[...]
Échelle des énergies
Une gamme d’énergies pour l’infiniment petit … L’unité d’énergie considérée pou[...]