Une structure en couches ….
La conquête de l’espace nous a habitué aux mouvements d’un satellite autour de la Terre. A l’aide de fusée d’appoints, les techniciens peuvent faire varier à volonté son énergie et sa trajectoire d’un satellite et l’amener ainsi à suivre n’importe quelle autre orbite
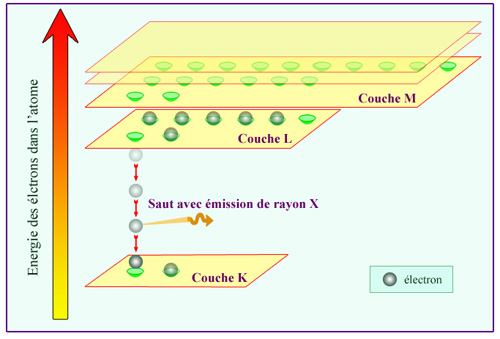
Niveaux d’énergie des électrons atomiques
Ce diagramme de l’énergie des électrons dans un atome fait apparaître sa structure en couches. La mécanique quantique n’autorise qu’un nombre limité de valeurs de l’énergie ou niveaux. Le niveau le plus bas (couche K) ne peut être occupé que par 2 électrons, le second niveau (couche L) par 8 électrons, le troisième (couche M) par 18 électrons. Les électrons de la couche K sont les plus proches du noyau. Sur l’atome de la figure, un électron de la couche K a été éjecté par le passage d’un rayonnement. La place disponible est immédiatement occupée par un électron de la couche L, qui « saute » au niveau inférieur en émettant un rayonnement X.
© IN2P3
L’électron qui tourne autour d’un noyau ne jouit pas de cette liberté. La nature lui impose un choix limité d’énergies, de la même façon que l’industrie impose aux mécaniciens une série de tailles de boulons : l’électron ne peut pas avoir n’importe quelle énergie. L’émission ou l’absorption de photons jouent le rôle des fusées d’appoint, en faisant sauter l’électron d’une « trajectoire » à une autre. Mais cette dernière ne peut qu’appartenir à une suite de trajectoires prédéfinies.
L’échelle microscopique est régie par la mécanique quantique. Il est préférable de parler de l’état d’un électron plutôt que de sa « trajectoire » : cet état est caractérisé par son énergie et la manière dont il occupe l’espace. Autour d’un noyau, le nombre d’états que peut occuper un électron est limité. On regroupe les différents états de même énergie sous le nom de « couches ». Les électrons d’un atome appartiennent à diverses couches caractérisées par une énergie. Ces couches sont appelés K, L, M, N… par les atomistes.
La couche K qui correspond à l’attraction la plus forte par le noyau est la première à se remplir. Deux électrons au maximum peuvent occuper cette couche. Un troisième électron n’y trouverait pas de place. Il doit se placer sur la couche suivante, la couche L, où il sera moins lié au noyau que les électrons de la couche K.
Les énergies de liaison des électrons sur les couches suivantes sont de plus en plus faibles. Quand une place devient disponible sur une couche, un électron situé sur une couche plus externe comble ce vide en sautant pour occuper la place laissée libre et être ainsi plus lié au noyau. Cette transition est accompagnée par l’émission d’un grain d’énergie « électromagnétique » qui hérite de la différence d’énergie de liaison entre les deux couches. Ces minuscules ondes électromagnétiques sont des photons dont certains – les photons lumineux – sont capables d’impressionner la rétine de l’œil.
L’énergie du photon est égale à la différence d’énergie des deux couches. L’énergie des couches étant caractéristiques de l’atome, celle du photon l’est aussi. La longueur d’onde de ce photon (c’est-à-dire sa couleur dans le cas de la lumière) étant reliée à son énergie, cette longueur d’onde est à son tour propre à l’atome.
La lumière et plus généralement les rayonnements émis sont donc caractéristiques de l’atome et du saut dans l’atome. Quand on analyse cette lumière par un prisme en fonction de la longueur d’onde, on observe une suite de raies, dont chacune correspond à un saut entre couches. Ces raies constituent une empreinte extraordinaire. Elles permettent d’identifier la présence et la nature des atomes présents dans des planètes ou des étoiles situées à des années lumières.
Les autres articles sur le sujet « Le monde atomique »
L’atome
Une masse concentrée dans le noyau et beaucoup de vide … L’atome est souvent représen[...]
Electron
Le plus connu des corpuscules élémentaires L »électron est un corpuscule qui joue un rôle fondame[...]
Photons
Les minuscules constituants de la lumière et des ondes électromagnétiques La lumière est composée[...]
Ordres de grandeur
Le très petit … et le très grand L’atome et plus encore le noyau appartiennent au monde de [...]
Le nombre d’avogadro
Des milliers de milliards de milliards d’atomes …. La contrepartie de l’extrême[...]
Einstein : E = Mc²
Masse et énergie interne d’une particule Les énergies dégagées dans les réactions chimiques[...]
Échelle des énergies
Une gamme d’énergies pour l’infiniment petit … L’unité d’énergie considérée pou[...]