S’exposer aux rayons ou laisser évoluer le cancer …
Depuis plus de 20 ans, on assiste à une augmentation régulière de la survie des malades traités pour un cancer. Cette amélioration, qui touche certains des cancers les plus fréquents comme le cancer du sein et le cancer colorectal, est due à la fois aux progrès thérapeutiques et à ceux du dépistage. Aujourd’hui, 2 à 3 % des personnes vivant en Europe ont eu un cancer, traité il y a plus de 2 ans et en ont été guéris. En France, ces survivants sont maintenant plus d’un million. La radiothérapie fait partie de leur traitement dans plus de la moitié des cas (Actuellement, on estime que plus de 45% des patients cancéreux sont guéris : 22% par la chirurgie, 18% par la radiothérapie dont 6% en association avec d’autres techniques).
La radiothérapie et la chimiothérapie qui sont à l’origine de ces progrès ont des effets cancérigènes qui peuvent être à l’origine d’un second cancer des années après. Ces effets s’expliquent par le mode d’action de ces thérapies, qui ne sont efficaces au niveau de la tumeur qu’en raison de leur toxicité. Il n’existe pas de modèle pour prédire cette toxicité à long terme.
La question se pose donc des cancers secondaires éventuellement induits par une radiothérapie. Bien que des progrès aient été réalisés avec l’utilisation d’électrons et de particules plus lourdes, ainsi qu’avec la curiethérapie, aucune technique ne peut à ce jour restreindre l’irradiation aux seuls tissus tumoraux.
Par exemple une étude portant sur 7711 femmes traitées pour un cancer du sein a montré que celles-ci avaient reçu en moyenne une dose de 9 grays à la thyroïde. L’iode-131 utilisé pour les cancers de cette même thyroïde délivre des doses de radiation significatives à la moelle osseuse, à la vessie et au système digestif.
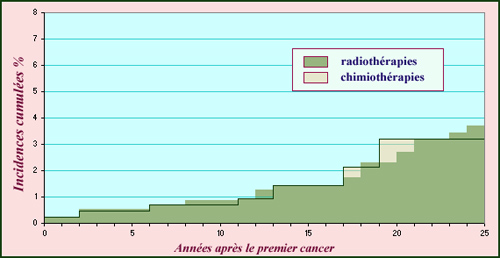
Cancer de l’enfant : risque des radiothérapies
L’incidence cumulée représente le taux de cancers apparus après le traitement d’un premier cancer. L’histogramme montre cette incidence en fonction des années écoulées pour une cohorte de 4500 enfants qui avaient été soignés pour un cancer par radiothérapie ou chimiothérapie entre 1943 et 1985. Sur 25 ans, le taux d’incidence d’un second cancer approche 4 % pour la radiothérapie comme pour la chimiothérapie. On estime que durant les 30 années suivant le traitement, les enfants traités par radiothérapies sont soumis à un risque 5 à 10 fois plus élevé que les enfants qui n’ont pas subi de premier cancer.
© IN2P3 (Source : Cancers secondaires des radiothérapies, par F.de Vathaire, revue Contrôle, N°156 (janvier 2004)72.
C’est surtout pour les enfants que le risque est important, car ils sont les plus sensibles aux rayons étant en période de croissance. Sur un échantillon d’enfants traités par des rayons pour un cancer solide et suivis par la suite sur une longue période, on a observé une probabilité accrue d’un second cancer longtemps après.
Mais ce danger, similaire à celui encouru d’une chimiothérapie, doit être mis en regard des années de vie que ces enfants n’auraient pas eues si leur premier cancer n’avait pas été soigné.
Les radiothérapeutes ont également observé depuis longtemps une « radiosensibilité » particulière chez certains patients, qui se manifeste durant ou après un traitement par des effets secondaires indésirables touchant les tissus normaux, provoquant par exemple des brûlures. L’évaluation de la radiosensibilité chez les patients traités pour cancer devrait permettre, à terme, la mise au point d’une radiothérapie personnalisée dont la dose serait adaptée pour éviter ou minimiser les effets secondaires tout en améliorant la curabilité des tumeurs.
Le risque existe et il ne faut pas le dissimuler : de nombreuses séries de patients ont été étudiées et les statistiques épidémiologiques correspondantes publiées. Ces travaux se poursuivent et sont suivis de près par les cancérologues et les radiothérapeutes. Mais en attendant l’apparition hypothétique de nouvelles technologies anti-cancéreuses, on ne peut qu’accepter un risque à long terme assez minime, comparé à un résultat positif quasi certain à court terme.
Prenons le cas d’un patient chez lequel on suspecte l’existence d’une tumeur à développement rapide, inaccessible à la chirurgie et susceptible d’atteindre ses fonctions vitales dans un délai de quelques semaines à quelques mois. Si on peut, par des techniques utilisant les rayonnements (radiographie, scintigraphie, radiothérapie) localiser puis détruire son cancer, on sait d’avance qu’on va avant tout lui sauver la vie, mais aussi affaiblir un peu son organisme et peut-être même l’exposer au risque de développer un second cancer, radioinduit celui-là, dans un délai qui se compte en années, voire en dizaines d’années. Et, répétons-le, il s’agit là d’une éventualité qui n’a qu’une chance statistique relativement faible de se produire.
Dans ces conditions, c’est évidemment au médecin ou au groupe de médecins qui a pris en charge le patient que revient la responsabilité de déclencher telle ou telle action qui devra respecter le principe du bénéfice maximal, grâce à une stratégie adaptée à chaque cas. Mais entre un risque fatal immédiat et un risque possible à très long terme, il y a peu de place pour l’hésitation.
Yvon Grall Professeur émérite de biophysique et de médecine nucléaire
Les autres articles sur le sujet « Expositions en médecine »
Dosimétrie des examens
De la simple radiographie aux scintigraphies et examens TEP Les examens de médecine nucléaire de [...]
Doses : scanners et rayons X
Radioprotection médicale : expositions en radiodiagnostic La très grande majorité des diagnostics[...]
Doses en scintigraphies et TEP
Radioprotection médicale : doses en diagnostic nucléaire Les examens de médecine nucléaire ne son[...]
Doses en radiothérapies
Thérapies : de fortes doses mais locales Les thérapies proprement nucléaires (curiethérapies, thé[...]
Doses hors radiothérapies
Des doses locales importantes En dehors de la radiothérapies, les rayonnements utilisés sont d&rs[...]