La protonthérapie : une radiothérapie aboutie et de précision
La protonthérapie consiste à traiter des tumeurs avec des protons accélérés. Cette technique de pointe est réservée aux cas où les tumeurs se trouvent à proximité d’organes critiques et sensibles aux radiations, quand les méthodes classiques deviennent dangereuses ou peu efficaces.
Pourquoi des protons ? Parce que le parcours de cette particule dans la matière est très différent de celui des élecrons et rayons X généralement utilisés en radiothérapies. Les accélérateurs permettent d’ailleurs d’utiliser d’autres particules chargées, comme des ions de carbone
Historiquement, l’idée d’utiliser des particules produites par des accélérateurs contre les cancers est due en 1946 au physicien américain Robert Rathbun Wilson. Les pionniers de la protonthérapie utilisèrent des accélérateurs dédiés à la physique, les premiers à Upsala en Suède (1957) et Harvard (1961) aux USA. La première installation dédiée à la protonthérapie, fut celle en 1989 du Claterbridge Center for Oncology au Royaume Uni.
Bien qu’encore marginales, les protonthérapies et plus généralement les hadronthérapies sont depuis deux décennies en plein développement. Fin 2016, 67 centres opéraient dans le monde. En 2021, 130 centres devaient être en opération. Le nombre de patients traités était passé de 61 800 en 2007 à 168 000 en 2016.
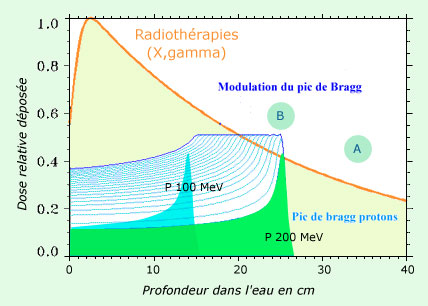
Principe de la protonthérapie
La figure montre l’avantage d’utiliser des protons plutôt que des rayons gamma ou X quand un tissu sensible (A) est situé derrière la tumeur située en B. L’absorption des rayons étant progressive, l’irradiation touche aussi le tissu sensible. Au contraire, les protons qui s’arrêtent à une certaine profondeur fonction de leur énergie déposent le maximum d’énergie en fin de parcours. Les protons étant fournis par un accélérateur, on peut régler leur direction et leur énergie pour que le pouvoir destructeur soit maximum dans la tumeur et épargne l’organe sensible situé derrière.
IN2P3
Les particules alpha constituent a priori des armes de choix pour détruire les cellules cancéreuses car elles sont très ionisantes. Elles déposent toute leur énergie sur un très court parcours mais leur pouvoir de pénétration est malheureusement faible. D’où l’idée de les remplacer par des particules nucléaires plus pénétrantes et de communiquer à ces particules une énergie suffisante pour qu’elles puissent atteindre des tumeurs profondes. Il faut recourir à un accélérateur pour cela. On accélère généralement des protons, d’où l’appellation de protonthérapie.
L’énergie à communiquer aux protons accélérés est très supérieure aux quelques MeV des désintégrations radioactives. Il faut une énergie de 200 MeV pour pénétrer de 20 cm dans l’eau, milieu dont la densité est voisine de la matière vivante, 50 fois environ l’énergie des rayons alpha du radium.
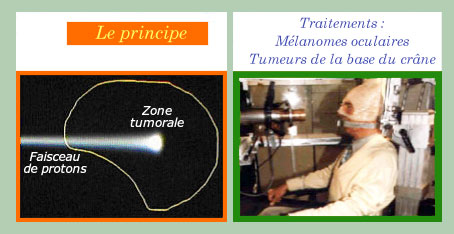
Une thérapie « conformationnelle »
Le schéma de gauche montre que les protons ne déposent pas leur l’énergie au delà d’une certaine profondeur. Il faut régler cette énergie et la direction pour qu’ils irradient au maximum la zone à traiter. En variant les énergies et angles d’attaque on arrive à épouser la forme de la tumeur. Il faut évidemment, étant donné la précision balistique, que le patient reste absolument immobile (à droite) et que l’on dispose de repères précis et fixes pour accroître la dose là où il faut et la réduire dans les tissus sains avoisinants.
© Centre de protonthérapie d’Orsay
Disposer d’un accélérateur donne encore un avantage balistique, la possibilité de diriger avec précision les particules sur la tumeur, alors que si l’on s’en remet aux hasards des désintégrations radioactives les rayons sont émis dans toutes les directions.
Les protons déposent le maximum d’énergie en fin de parcours. Quand le proton pénètre dans le corps, l’énergie déposée par ionisation s’accroît d’abord lentement au fur et à mesure qu’il se ralentit pour augmenter beaucoup juste avant de s’arrêter. Cette fin de parcours, où la dose délivrée est élevée, est appelée le pic de Bragg. Il s’agit de faire en sorte pour une thérapie que ce maximum de dégâts se produise dans la tumeur.
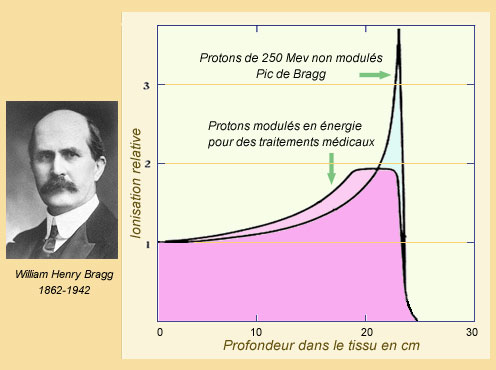
La courbe de Bragg
La propriété pour des particules comme les protons de perdre le maximum d’énergie avant de s’arrêter a été mise en évidence par le physicien anglais William Bragg. L’énergie déposée par ionisation dans un tissu en fin de parcours est près de 3 fois plus importante qu’au début. La courbe passe par un pic. Le parcours – quasi rectiligne – varie peu d’un proton à l’autre. Il est environ de 25 cm pour une énergie de 250 MeV. En variant l’énergie des protons, on diminue la hauteur du pic de Bragg mais on augmente l’épaisseur de la tranche ou l’irradiation est plus forte.
© IN2P3
Une des principales indications de la protonthérapie est le mélanome de la choroïde, une maladie gravissime qui nécessitait auparavant l’énucléation de l’œil et contre laquelle on ne pouvait recourir aux radiothérapies classiques en raison de la proximité de l’hypophyse.
Dans les tumeurs de la base du crâne résistantes aux radiations (chondromes et chondrosarcomes) la protonthérapie autorise d’augmenter la dose dans la tumeur tout en ménageant les zones critiques comme les nerfs optiques, le tronc cérébral, les oreilles internes ou la moelle épinière.
Les résultats les plus impressionnants ont été obtenus pour les mélanomes de l’œil. La dose est de 60 grays. Près de 96 % de 2500 patients traités au Centre de Protonthérapie d’Orsay n’avaient pas eu de récidives 5 ans après et gardaient leur œil. Pour les traitements intracrâniens 400 adultes avaient été traités en parallèle à Orsay. La protonthérapie associée à une radiothérapie classique permet d’augmenter le contrôle de la tumeur à 5 ans jusqu’à 85-90 % , alors que les chondromes de la base du crâne entraînent la mort en 2 à 3 ans en raison de la fragilité des éléments neurologiques encéphaliques.
Compte tenu de sa haute technicité, des équipements lourds qu’elle nécessite et de son coût, la protonthérapie reste une médecine sur mesure. Ainsi en 2003, 540 patients avaient été traités à comparer aux 8000 et 170 000 patients traités par curiethérapie et radiothérapie.
En France, il existe deux centres principaux de protonthérapie, celui d’Orsay et le Centre Antoine Lacassagne à Nice. D’autres centres de hadronthérapie ont été créés à Caen, Lyon et Toulouse. Après une rénovation complète en 2010 , le centre de protonthérapie d’Orsay peut accueillir après 4 années de transformations 550 patients par an dont au moins 120 enfants. Le centre rénové est équipé d’un accélérateur de dernière génération – un cyclotron – et d’une nouvelle salle de traitement avec un bras isocentrique, un dispositif permettant d’orienter l’axe du faisceau par rapport au malade.
Depuis son ouverture en 1991, le centre Antoine Lacassagne de Nice avait traité en 2016, plus de 5500 patients pour des tumeurs oculaires. Une nouvelle installation de protonthérapie y a été inaugurée le 30 juin 2016 pour traiter tous types de tumeurs situées profondément à l’intérieur du corps humain. Sa capacité initiale prévue est de 250 patients par an.
S’étant initialement développée pour les tumeurs de l’œil et les tumeurs intercrâniennes, la protonthérapie voit un élargissement considérable de ses indications, en particulier en pédiatrie en raison de la diminution du risque de séquelles liées au traitement.
Les autres articles sur le sujet « Radiothérapie Avancée »
Curiethérapies
La plus ancienne thérapie nucléaire aujourd’hui modernisée La Curiethérapie est la plus anc[...]
Curiethérapie de la prostate
Une destruction efficace de cellules cancéreuses On observe depuis les années 2000, en particulie[...]
Radiothérapies métaboliques
Des radioisotopes en interne à but thérapeutique Les applications des radioisotopes en médecine n[...]
Hadronthérapies
Autres thérapies nucléaires avancées … Les hadrons sont des particules élémentaires dont le[...]